जीवन में जल का महत्त्व (Importance of Water in Life)
जीवन की उत्पत्ति जल में हुई और जल में ही अनेक प्रकार की प्राचीन जीव जातियों का उद्विकास (evolution) हुआ। आज भी पृथ्वी पर जीवों का अस्तित्व जल के भौतिक रासायनिक गुणों पर निर्भर करता है। याद रखो,
"पृथ्वी के जीव एक जलीय ग्रह (पृथ्वी) पर जलीय तन्त्रों के रूप में हैं"
("Earthly organisms are aqueous systems on a watery planet")
परिचय
- पृथ्वी पर प्रारम्भ से जल ही सबसे अधिक पाया जाने वाला पदार्थ है। लगभग तीन-चौथाई पृथ्वी जल से ढकी हुई है।
- जीवों में भी शरीर के भार का लगभग 50 से 90% जल होता है। वास्तव में तो हम जल के बिना जीवन की कल्पना भी नहीं कर सकते, क्योंकि जीव कोशिकाएँ तभी काम कर सकती हैं जब इनमें 65 से 70% जल हो और इनके चारों ओर भी जलीय माध्यम हो।
- हमारा स्वयं का शरीर लगभग 57% (नवजात शिशु में 75% तक) जल होता है, अर्थात् एक 70kg भार के व्यक्ति के शरीर में लगभग 40 लीटर जल होता है।
- इस जल का लगभग आधा भाग शरीर की कोशिकाओं में और आधा रुधिर प्लाज्मा (blood plasma), लसिका (lymph) और ऊतक द्रव्य (tissue fluid) में होता है। कोशिकाओं के जीवद्रव्य (कोशिकीय मैट्रिक्स या साइटोसॉल cytoplasmic matrix or cytosol) में अधिकांश जल स्वतन्त्र या मुक्त जल (free or bulk water) के रूप में होता है।
- शेष जल के अणु, हाइड्रोजन बन्धों (hydrogen bonds) द्वारा प्रोटीन अणुओं की सतह पर जुड़े होते हैं और इन अणुओं की जटिल संरचना को स्थायित्व देते हैं। इस जल को बँधा हुआ जल (bound water) कहते हैं।
- बीजों और बीजाणुओं (spores) में केवल 10 से 12% ही जल होता है। इसीलिए ये प्रसुप्त (dormant) रहते हैं और जल उपलब्ध होने पर ही पुनः सक्रिय होकर अंकुरित होते हैं।
- हमारे शरीर का dehydration होने पर हमारी दशा गम्भीर हो जाती है और उपचार न किया जाए तो शीघ्र मृत्यु हो जाती है।
जल के भौतिक गुण (Physical Properties of Water)
- शुद्ध जल रंगहीन, पारदर्शी (transparent), स्वादहीन, गन्धहीन होता है। गहरे जल में नीली-सी झलक (tinge) होती है।
- तरल जल 0°C ताप पर ठोस बर्फ में जम जाता है और 100°C ताप पर उबलकर गैसीय भाप (जलवाष्प) में बदल जाता है।
- इसका अधिकतम् घनत्व (density) 4°C ताप पर और 1.00 होता है। इसका pH 7.00 अर्थात् उदासीन (neutral) होता है।
- जल में विद्युत चालकता अपेक्षाकृत कम, परन्तु विशिष्ट ऊष्मा (specific heat), वाष्पीकरण की गुप्त ऊष्मा (latent heat of vaporization), क्वथनांक (boiling point) एवं गलनांक (melting point) तथा संसंजक (cohesive) और आसंजक (adhesive) बल (forces) अधिक होते हैं।
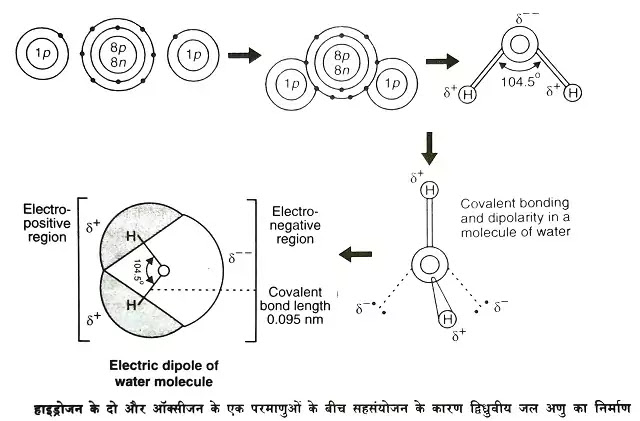
जल के अणु की संरचना (Structure of Water Molecule)
- रासायनिक रूप से जल का अणु ऑक्सीजन का हाइड्राइड (hydride of oxygen) होता है।
- एक ऑक्सीजन परमाणु में दो कक्षों (orbits) में 8 इलेक्ट्रॉन (electrons) होते हैं, 2 भीतरी और 6 बाहरी कक्षों में।
- हाइड्रोजन अणु में एक ही इलेक्ट्रॉन की एक कक्षा होती है।स्थाई होने के लिए ऑक्सीजन परमाणु को बाहरी कक्षा में 2 तथा हाइड्रोजन परमाणु को अपनी इलेक्ट्रॉन कक्षा में 1 अतिरिक्त इलेक्ट्रॉन की आवश्यकता होती है।
- जब हाइड्रोजन के दो परमाणु अपने-अपने इलेक्ट्रॉन की ऑक्सीजन के एक परमाणु के दो unpaired इलेक्ट्रॉन्स से साझेदारी करके सहसंयोजी बन्ध (covalent bonds) बना लेते हैं तो जल (H2O) का एक स्थाई अणु बन जाता है।
- इस प्रकार जल ऑक्सीजन का हाइड्राइड होता है। इसके अणु में ऑक्सीजन के परमाणु से जुड़ने वाले हाइड्रोजन के परमाणु एक-दूसरे से 180 डिग्री के बजाय केवल 104.5 डिग्री के कोण पर अलग होते हैं।
- जल के अणु की ऑक्सीजन परमाणु वाली दिशा में अधिक ऋणात्मक (negative) तथा हाइड्रोजन परमाणुओं वाली दिशा में अधिक धनात्मक (positive) आवेश (charge) होता है।
- इस असममित सहसंयोजन के कारण ही इलेक्ट्रॉन्स एवं प्रोटोन्स की संख्या बराबर होते हुए भी जल का अणु द्विध्रुवीय (dipolar) होता है।
जल तथा बर्फ का बनना (Formation of Water and Ice)
- जल के एक अणु के धनात्मक आवेशित हाइड्रोजन परमाणुओं और दूसरे अणु के ऋणात्मक आवेशित ऑक्सीजन परमाणु के बीच काफी आकर्षण होता है। अतः निकटवर्ती जल अणु हाइड्रोजन बन्ध (H-bonds) बनाकर एक-दूसरे से जुड़ जाते हैं।
- इससे स्पष्ट है कि जल का प्रत्येक अणु चार हाइड्रोजन बन्धों द्वारा चार अन्य निकटवर्ती अणुओं से जुड़ सकता है।
- यद्यपि सहसंयोजी न होने के कारण, हाइड्रोजन बन्ध निर्बल होते हैं, फिर भी चारों दिशाओं में इनके बड़ी संख्या में बन जाने के कारण जल के अणु काफी स्थाई जल का निर्माण कर लेते हैं।
- जल में इन हाइड्रोजन बन्धों का एक व्यापक त्रिविम जाल (3-dimensional lattice network) फैला होता है जिसमें कि हाइड्रोजन बन्धों की चतुष्फलकीय (tetrahedral) आकृतियाँ बनाने की प्रवृत्ति होती है। इसी त्रिविम जाल के कारण जल में कई भौतिक गुण होते हैं।
- पृथ्वी पर जल ही अकेला ऐसा पदार्थ है जो तीनों भौतिक दशाओं—ठोस, तरल और गैसीय दशाओं में पाया जाता है। बहुत ठण्डा होने पर यह ठोस क्रिस्टलीय (crystalline) बर्फ में जम जाता है।
- इस प्रक्रिया में तरल जल के सारे हाइड्रोजन बन्ध टूट जाते हैं और फिर इनके दोबारा बनने से एक अलग प्रकार का अधिक खुला सा त्रिविम जाल बनता है जिसमें चतुष्फलकीय आकृतियाँ नहीं बनती हैं।
- यह स्पष्ट है कि बर्फ के जमने में काफी समय लगता है, इसमें हाइड्रोजन बन्ध फैले और अपेक्षाकृत कम निर्बल होते हैं और बर्फ अधिक स्थान घेरती है। इसीलिए बर्फ जल से अधिक फैलती है और इसका घनत्व भी कुछ कम होता है।
- पृथ्वी पर जल ही ऐसा पदार्थ है जो ठण्डा होकर जमने पर फैलता है। अन्य सभी पदार्थ ठण्डे होकर जमने पर सिकुड़ते हैं।
- बर्फ के वापस जल में पिघलने में भी पहले बर्फ के सारे हाइड्रोजन बन्ध टूटते हैं। इसी प्रकार, गर्म होने पर तरल जल के हाइड्रोजन बन्ध धीरे-धीरे टूटते हैं जिससे जल भाप बनकर उड़ता है। इन दोनों प्रक्रियाओं में इसीलिए काफी समय लगता है। यही कारण है कि जल की विशिष्ट ऊष्मा, गलनांक तथा वाष्पीकरण की गुप्त ऊष्मा अधिक होती है।
जल की विलेयता (Solubility of Water)
जल के अणुओं का ध्रुवीय स्वभाव तथा इनकी हाइड्रोजन बन्ध बनाने की क्षमता के कारण जल में अद्वितीय विलेयता होती है। यह नमक – सोडियम क्लोराइड (NaCl) जैसे आयनिक पदार्थों अर्थात् इलेक्ट्रोलाइट्स (ionic substances or electrolytes) के लिए, शर्कराओं, ऐल्कोहॉल्स तथा ऐमीन्स जैसे अनआयनिक, परन्तु ध्रुवीय पदार्थों के लिए तथा ऐल्डिहाइड्स एवं कीटोन्स जैसे कार्बोनिलयुक्त पदार्थों के लिए एक आदर्श विलायक (ideal solvent) होता है।



No comments:
Post a Comment