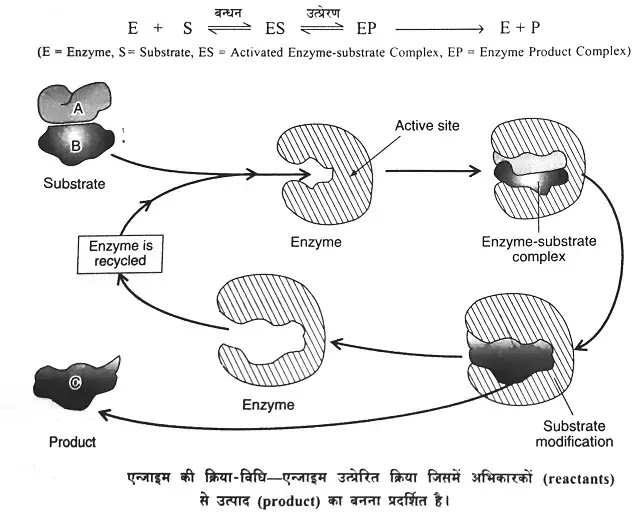
एन्जाइम क्रिया सामान्य विधि से तीन चरणों में सम्पन्न होती है। एन्जाइम (E) पहले तो क्रियाधार (S) से बन्ध जाता है और फिर एन्जाइम क्रियाधार सम्मिश्र (activated enzyme-substrate complex - ES) का निर्माण होता है जो अन्ततः क्रियाधार (substrate) को बदल देता है और उत्पाद (product) का निर्माण करता है। क्रिया के अन्त में एन्जाइम बिना बदले अलग हो जाता है। एन्जाइम द्वारा उत्प्रेरित अभिक्रिया को निम्नलिखित समीकरण से व्यक्त करते हैं-
एन्जाइम, अभिक्रिया की सक्रियण ऊर्जा (activation energy) को कम करके अभिक्रिया की गति को तेज कर देते हैं। विकरों (enzymes) की सतह पर कुछ विशिष्ट क्षेत्र होते हैं जिनसे क्रियाधार (substrate) attached होते हैं और उत्प्रेरण होने लगता है। इन विशिष्ट क्षेत्रों को सक्रिय स्थल (active sites) कहते हैं।
एन्जाइम (enzyme) क्रियाधार (reactants=substrate) की पहचान कर उसे क्रिया स्थल (active site) पर बाँध लेता है और सक्रियता एन्जाइम क्रियाधार सम्मिश्र (activated enzyme-substrate complex) बना लेता है। एन्जाइम, क्रियाधार के भीतर विशिष्ट आबन्धों पर क्रिया करता है जिसके परिणाम स्वरूप उत्पाद का निर्माण होता है। इस प्रकार एन्जाइम, ऊर्जा रोधक (energy barrier) के प्रभाव को कम कर देता है।
एन्जाइम अभिक्रिया की सन्तुलन अवस्था को नहीं बदलता, केवल उसकी गति को बढ़ाता है, जिसके द्वारा अभिक्रिया सन्तुलन की अवस्था को प्राप्त होती है। यही नही; चूँकि एन्जाइम किसी अभिक्रिया में भाग लेने पर स्थायी रूप से नहीं बदलते इसलिये एन्जाइम जिस रूप में क्रिया के प्रारम्भ में होते हैं ठीक उसी रूप में अभिक्रिया के पश्चात् बाहर हो जाते हैं और पुनः अभिक्रिया को उत्प्रेरित करने के लिये तैयार हो जाते हैं।
एन्जाइम उत्प्रेरण की क्रिया-विधि (mechanism of enzyme catalysis) को समझाने के लिये निम्नलिखित दो परिकल्पनाएँ दी गयी हैं-
1. ताला-चाबी परिकल्पना (Lock-and-Key Hypothesis) — इस परिकल्पना का प्रतिपादन एमिल फिशर (Emil Fisher—1894) ने किया था। जिस तरह किसी ताले (lock) में विशेष प्रकार की चाबी (key) समावेशित हो सकती है उसी प्रकार क्रियाधार (substrate) का विशेष विकर (enzyme) के सक्रिय स्थल (active site) पर बन्धन होता है। इस प्रकार एक मध्यवर्ती विकर-क्रियाधार सम्मिश्र (enzyme-substrate complex) बन जाता है।
एन्जाइम उत्प्रेरण की क्रिया-विधि (mechanism of enzyme catalysis) को समझाने के लिये निम्नलिखित दो परिकल्पनाएँ दी गयी हैं-
1. ताला-चाबी परिकल्पना (Lock-and-Key Hypothesis) — इस परिकल्पना का प्रतिपादन एमिल फिशर (Emil Fisher—1894) ने किया था। जिस तरह किसी ताले (lock) में विशेष प्रकार की चाबी (key) समावेशित हो सकती है उसी प्रकार क्रियाधार (substrate) का विशेष विकर (enzyme) के सक्रिय स्थल (active site) पर बन्धन होता है। इस प्रकार एक मध्यवर्ती विकर-क्रियाधार सम्मिश्र (enzyme-substrate complex) बन जाता है।
प्रायः विकर में एक से अधिक सक्रिय स्थल होते हैं। विकर-क्रियाधार सम्मिश्र (enzyme-substrate complex) बनने से ही क्रियाधार (substrate) के अणुओं की सक्रियण ऊर्जा (energy of activation) में कमी आती है। इससे क्रियाधार के अणु सक्रिय (activated) हो जाते हैं और सम्मिश्र (E-S complex) बनने के साथ ही substrate के अणु रूपान्तरित हो जाते हैं। यह सम्मिश्र अत्यधिक अस्थिर (unstable) होता है। इस सम्मिश्र के टूटने के परिणामस्वरूप क्रियाधार के अणु अन्तिम उत्पादों (end products) में परिवर्तित हो जाते हैं और विकर अपने पूर्व रूप में पृथक् हो जाता है।
(2) ताला-चाबी परिकल्पना (Lock-and-Key Hypothesis) – इस परिकल्पना को कोशलैण्ड (Koshland, 1960) ने प्रतिपादित किया। इस परिकल्पना के अनुसार, एन्जाइम के सक्रिय स्थल (active site) की रचना दृढ़ नहीं होती बल्कि लचीली होती है, प्रारम्भ में सक्रिय स्थल की रचना, क्रियाधार (substrate) की रचना के अनुपूरक (complementary) नहीं होती, परन्तु जैसे ही क्रियाधार, एन्जाइम के सम्पर्क में आता है तो एन्जाइम का सक्रिय स्थल, क्रियाधार (substrate) की रचना के अनुरूप होने के लिए प्रेरित हो जाता है।
फलस्वरूप एन्जाइम - क्रियाधार- सम्मिश्र (enzyme substrate complex) बन जाता है। विकर के अणुओं में आकारात्मक (structural) परिवर्तन, क्रियाधार (substrate) द्वारा प्रेरित (induced) होता है।
.webp)
.webp)
.webp)


No comments:
Post a Comment