व्युत्क्रम या तुल्य अनुपात के नियम के अनुसार-
यदि कोई तत्व A दो अन्य तत्वों B व C से अलग-अलग संयोग करता है तथा B व Cभी एक-दूसरे से संयोग करते हैं तो B व C भारानुसार उस अनुपात में या उसके सरल गुणित अनुपात में संयोग करेंगे जिसमें B व C अलग-अलग A के किसी निश्चित द्रव्यमान से संयोग करते हैं।
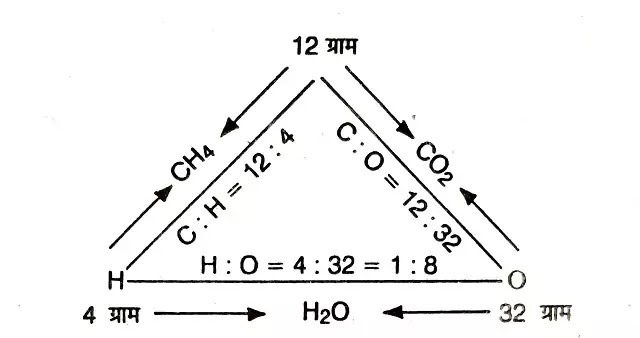
व्युत्क्रम अनुपात के नियम को निम्नलिखित उदाहरण की सहायता से स्पष्ट किया जा सकता है-
कार्बन (C) व हाइड्रोजन (H) रासायनिक संयोग करके मेथेन (CH4) बनाते हैं। मेथेन के 16 ग्राम में 12 ग्राम कार्बन व 4 ग्राम हाइड्रोजन होते हैं। कार्बन (C) व ऑक्सीजन (O) रासायनिक संयोग करके कार्बन डाइऑक्साइड (CO2) बनाते हैं। कार्बन डाइऑक्साइड के 44 ग्राम में 12 ग्राम कार्बन एवं 32 ग्राम ऑक्सीजन होते हैं। अत: कार्बन की समान मात्रा (12 ग्राम) से अलग-अलग संयुक्त होने वाले हाइड्रोजन तथा ऑक्सीजन के द्रव्यमानों का अनुपात 4 ग्राम : 32 ग्राम अर्थात् 1: 8 है।
व्युत्क्रम अनुपात के नियम के अनुसार जब हाइड्रोजन व ऑक्सीजन परस्पर संयोग करेंगे तो उनके द्रव्यमानों का अनुपात यही होगा अथवा इसका सरल गुणक होगा। हाइड्रोजन व ऑक्सीजन के परस्पर संयोग से बने जल (H2O) में इन दोनों तत्वों का भारात्मक अनुपात 1:8 ही होता है। हाइड्रोजन व ऑक्सीजन के परस्पर संयोग से बने हाइड्रोजन परॉक्साइड में इन दोनों तत्वों का भारात्मक अनुपात 1:16 है, जो 1:8 का सरल गुणक है।
नोट-कुछ यौगिकों में तत्वों के परमाणुओं की संख्याएँ अधिक होती हैं। गुणित अनुपात के नियम की भाँति यह नियम भी उन यौगिकों के लिए सत्य नहीं होगा।
नोट-कुछ यौगिकों में तत्वों के परमाणुओं की संख्याएँ अधिक होती हैं। गुणित अनुपात के नियम की भाँति यह नियम भी उन यौगिकों के लिए सत्य नहीं होगा।



No comments:
Post a Comment