बोर द्वारा प्रस्तावित परमाणु मॉडल (Bohr's Model of an Atom)
नील्स बोर (Neils Bohr) ने 1913 में रदरफोर्ड के नाभिकीय मॉडल का एक संशोधित एवं विस्तृत रूप प्रस्तुत किया था। नील्स बोर ने मैक्स प्लांक (Max Planck) के क्वांटम सिद्धांत (Quantum Theory) का उपयोग किया था जिसके अनुसार ऊर्जा का उत्सर्जन या अवशोषण निरंतर क्रम में नहीं होता बल्कि ऊर्जा के पैकेट (Packets) के रूप में होता है। ऊर्जा के इन पैकेटों को क्वांटा (Quanta) कहते हैं।
बोर ने रदरफोर्ड द्वारा प्रस्तावित परमाणु मॉडल की कमियों को दूर करने के लिए उससे बिना परिवर्तित किए हैं कुछ अनुमान किए जो इस प्रकार है
• परमाणु में इलेक्ट्रॉन नाभिक के चारों ओर निश्चित वृत्तीय कक्षाओं में घूर्णन करते हैं इन कक्षाओं को कक्षा(Orbits) या कोश(Shell) कहते हैं।
• इलेक्ट्रॉन इन सभी कक्षाओं में नहीं घूमते हैं बल्कि यह केवल कुछ निश्चित कक्षाओं में और निश्चित संख्याओं में घूमते हैं। इन निश्चित कक्षाओं को स्थाई(Stable) अथवा स्थिर कक्षा कहते हैं।
• प्रत्येक कोश अथवा कक्षा की निश्चित ऊर्जा होती है जिसे ऊर्जा कोश अथवा ऊर्जा स्तर भी कहते हैं।
• प्रत्येक इलेक्ट्रॉन के साथ उसकी गति तथा स्थिति के कारण ऊर्जा की एक निश्चित मात्रा निहित होती है। किसी एक निश्चित कक्षा में घूमने वाले सभी इलेक्ट्रॉन की ऊर्जा समान होती है।
• इलेक्ट्रॉन जब स्थाई कक्षाओं में घूमते हैं हो ऊर्जा का उत्सर्जन नहीं करते हैं अर्थात इस समय घूमते हुए इनकी ऊर्जा का ह्रास नहीं होता है।
• स्थाई कक्षाओं में घूमते हुए इलेक्ट्रॉनों की कक्षाओं को n:n की पूर्ण संख्याओं द्वारा वर्गीकृत किया जा सकता है जहां n एक पूर्णांक है। n का मान 1,2,3,4 आदि हो सकता है। यह संख्या इलेक्ट्रॉनों की कक्षा की क्रम संख्या कहलाती है। इलेक्ट्रॉनों की कक्षाओं को क्रमशः K,L,M,N आदि अक्षरों द्वारा प्रदर्शित करते हैं।
- इलेक्ट्रॉन तथा नाभिक के मध्य की दूरी को नापने के लिए इस सूत्र का प्रयोग कर सकते हैं- mvr=nh/2𐍀 जहां इलेक्ट्रॉन का द्रव्यमान m ,वेग v तथा परमाणु के केंद्र से इलेक्ट्रॉन की दूरी r है। इलेक्ट्रॉन तथा नाभिक के मध्य में आकर्षण बल कार्य करता है तथा वह अपकेंद्र बल से संतुलित रहता है इस आधार पर n,r तथा इलेक्ट्रॉन की ऊर्जा के बारे में महत्वपूर्ण जानकारी मिलती है कि यदि पूर्णांक(n) का मान अधिक है तो दूरी(r) का मान भी अधिक होगा तथा इलेक्ट्रॉन की ऊर्जा भी अधिक होगी,अर्थात पहले से शुरू होकर दूसरी, तीसरी आदि कक्षाओं की नाभिक से दूरी तथा उनकी इलेक्ट्रॉनों की ऊर्जा बढ़ती जाती है। अतः n को इलेक्ट्रान का ऊर्जा स्तर(Energy Level) भी कहतें हैं।
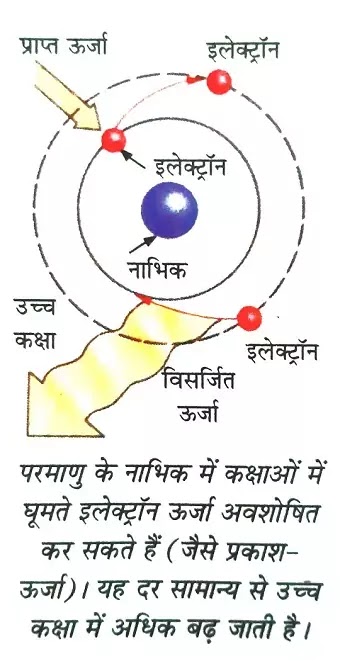
- इलेक्ट्रॉन पहले परमाणु में निम्न ऊर्जा की कक्षाओं में रहते हैं तथा परमाणु की यह अवस्था उनकी मूल अवस्था(Ground State) कहलाती है। जब इलेक्ट्रॉन को बाहर से ऊर्जा मिलती है तो वह अपनी मूल अवस्था को छोड़कर उच्च ऊर्जा वाली या दूर वाली कक्षाओं में कूद जाते हैं जिससे ऊर्जा का अवशोषण(Absorption of Energy) होता है और परमाणु या इलेक्ट्रॉन की इस अवस्था को उसकी उत्तेजित अवस्था(Excited State) कहते हैं।
- जब इलेक्ट्रॉन अपनी मूल कक्षा को छोड़कर दूसरी कक्षा में पहुंच जाता है तो दो संभावनाएं हो सकती हैं ऊर्जा का अवशोषण हो तथा इलेक्ट्रॉन भी उच्च कक्षा में पहुंच जाएं या ऊर्जा का उत्सर्जन हो और इलेक्ट्रॉन लौटकर अपनी मूल अवस्था में वापस आ जाए। जब परमाणु बहुत अधिक होते जब अवस्था में होता है तो ऊर्जा के अवशोषण की संभावना नहीं होती है तो ऊर्जा का उत्सर्जन होता है और यह तब होता है जब इलेक्ट्रॉन दूर वाले कक्षा से पास वाली कक्षा में लौट आता है।
बोर के परमाणु मॉडल की कमियां (Drawbacks of the atomic model of Bohr)
• बोर के परमाणु मॉडल द्वारा केवल एक इलेक्ट्रॉन वाले परमाणु जैसे हाइड्रोजन या आयनों के उत्सर्जन स्पेक्ट्रम की उत्पत्ति की व्याख्या की जा सकी है। एक से अधिक इलेक्ट्रॉन वाले परमाणु की व्याख्या करने में यह मॉडल असंभव है।
• हाइड्रोजन के उत्सर्जन स्पेक्ट्रम की रेखाओं को उच्च विभेदन क्षमता(High resolving power) वाले स्पेक्ट्रोस्कोप(Spectroscope) द्वारा जाँचने पर यह पता चला कि जो रेखाएं एकल प्रतीत होती हैं वह वास्तव में रेखाओं का समूह है। बोर का परमाणु मॉडल स्पेक्ट्रम की सूक्ष्मा संरचना(Fine Structure) की व्याख्या करने में असंभव रहा।
• बोर के प्रयोग से यह पता चला कि जिस वस्तु से उत्सर्जन स्पेक्ट्रम प्राप्त होता है उसे चुंबकीय क्षेत्र में रख देने पर उसकी रेखाएं गई रेखाओं में विभक्त हो जाती हैं और इस घटना को जेमान प्रभाव कहते हैं जिसकी व्याख्या पर बोर के परमाणु मॉडल द्वारा संभव नहीं है।
अतः हम यह कह सकते हैं कि रदरफोर्ड के परमाणु मॉडल का अध्ययन करने के पश्चात बोर ने उनके परमाणु मॉडल की कमियों को दूर करने की कोशिश की किंतु बोर द्वारा प्रस्तावित मॉडल में भी कुछ कमियां थी जिसे वह समझाने में असमर्थ रहे।
इन्हें भी पढ़ें -


No comments:
Post a Comment