आयन (Ions)
परिभाषा(Definition)- जब परमाणु इलेक्ट्रॉन गवाँते अथवा प्राप्त करते हैं तब परमाणु विद्युत आवेशित कण में परिवर्तित हो जाते हैं ,जिन्हें आयन(Ion) कहते हैं।
आयन का निर्माण (Formation of Ions)
परमाणु वैद्युत रूप से उदासीन होता है। परमाणु परमाणु में धन आवेशित नाभिक तथा ऋणावेशित इलेक्ट्रॉन होते हैं। इलेक्ट्रॉन नाभिक के चारों ओर विभिन्न कक्षाओं में घूर्णन करते रहते हैं।सभी तत्वों के परमाणु उत्कृष्ट गैसों को छोड़कर इलेक्ट्रॉन प्राप्त अथवा गवाँ सकते हैं।
- इलेक्ट्रॉन गवाँने अथवा प्राप्त करने पर परमाणु विद्युत आवेशित कण में परिवर्तित हो जाते हैं ,जिन्हें आयन(Ion) कहते हैं।
- जब परमाणु एक अथवा अधिक इलेक्ट्रॉन गंवाते हैं तब धन आवेशित आयन का निर्माण होता है। जब परमाणु एक अथवा अधिक इलेक्ट्रॉन प्राप्त करता है तब ऋण आवेशित आयन बनता है।
- जब परमाणु एक अथवा अधिक इलेक्ट्रॉन गवाँता है तब धनायन का निर्माण होता है। और जब परमाणु एक अथवा अधिक इलेक्ट्रॉन प्राप्त करता है तब ऋणायन का निर्माण होता है।
- धन आवेशित आयन को धनायन (Cation) तथा ऋण आवेशित आयन को ऋणायन (Anion) कहते हैं।
X → X+ + e‐(एक इलेक्ट्रान की हानि)
यदि परमाणु Y एक इलेक्ट्रॉन प्राप्त करता है तो B‐ में परिवर्तित हो जाएगा।
B + e‐ → B‐ (एक इलेक्ट्रॉन की प्राप्ति)
धनायन की निर्माण(Formation of Cation)
तत्वों के वे परमाणु जिनके बाह्यतम कोश या कक्षाओं में 1 से 4 इलेक्ट्रॉन होते हैं। वे परमाणु इलेक्ट्रॉन गंवाने की ओर अभिमुख होते हैं। यह धन आवेशित आयन धनायन का निर्माण करते हैं। सभी धातुओं और हाइड्रोजन के परमाणु धनायन बनाने की ओर अभिमुख होते हैं क्योंकि हाइड्रोजन आयन में केवल एक प्रोटोन होता है।धनायन की विरचना के कुछ उदाहरण इस प्रकार हैं-
मैग्नीशियम एक धातु है जिसके परमाणु में 12 इलेक्ट्रॉन होते हैं। जिनका इलेक्ट्रॉनिक विन्यास 2,8,2 होता है तथा यह इलेक्ट्रॉन पहले 3 कोशों (K,L,M) में 2,8,2 के क्रम में व्यवस्थित रहते हैं। जब मैग्नीशियम अपने दो बाह्यतम इलेक्ट्रॉन गवाँता है तो मैग्निशियम (Mg²+) आयन का निर्माण होता है। Mg²+ एक धनायन है जिसमें धन आवेश की दो इकाइयां होती है।
मैग्नीशियम आयन की निर्माण (Formation of Magnesium Ion)
मैग्नीशियम एक धातु है जिसके परमाणु में 12 इलेक्ट्रॉन होते हैं। जिनका इलेक्ट्रॉनिक विन्यास 2,8,2 होता है तथा यह इलेक्ट्रॉन पहले 3 कोशों (K,L,M) में 2,8,2 के क्रम में व्यवस्थित रहते हैं। जब मैग्नीशियम अपने दो बाह्यतम इलेक्ट्रॉन गवाँता है तो मैग्निशियम (Mg²+) आयन का निर्माण होता है। Mg²+ एक धनायन है जिसमें धन आवेश की दो इकाइयां होती है।
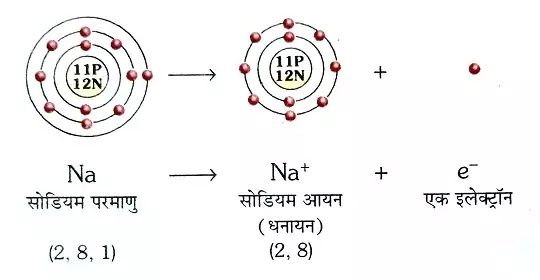
सोडियम आयन की निर्माण (Formation of Sodium Ion)
सोडियम भी एक धातु है। सोडियम के परमाणु में 11 इलेक्ट्रॉन होते हैं। इस का इलेक्ट्रॉनिक विन्यास 2,8,1 होता है। यह इलेक्ट्रॉन पहले 3 कोशों (K,L,M) में क्रम से व्यवस्थित रहते हैं इनका क्रम 2,8,1 ही होता है। जब सोडियम परमाणु (Na) एक इलेक्ट्रॉन गवांता है तब सोडियम आयन (Na+) का निर्माण होता हैं । Na+ आयन एक धनआयन है जिसमें धन आवेश की एक इकाई होती है।
ऋणायन का निर्माण (Formation of Anions)
तत्वों के वे सभी परमाणु जिनके बाह्यतम कोश में 5 से 7 इलेक्ट्रॉन होते हैं ,इलेक्ट्रॉन प्राप्त करने की ओर अभिमुख रहते हैं या इलेक्ट्रॉन प्राप्त करने के लिए तैयार रहते हैं। जब यह इलेक्ट्रॉन प्राप्त करते हैं तो इनके ऊपर ऋण आवेश आ जाता है जिससे ऋणावेशित आयन (ऋणायन) का निर्माण होता है। कुछ अभिक्रियाओं में हाइड्रोजन परमाणु भी एक इलेक्ट्रॉन प्राप्त कर ऋण आयन बनाता है (हाइड्रोजन आयन ,H‐)। अतः सभी अधातु तथा हाइड्रोजन ऋणायन, ऋण आवेशित आयन बनाने की ओर अभिमुख होते हैं।ऋणायन की विरचना के कुछ उदाहरण इस प्रकार हैं-
क्लोराइड आयन की निर्माण ( Formation of Chloride Ion)
क्लोरीन एक अधातु है। क्लोरीन के एक परमाणु में 17 इलेक्ट्रॉन होते हैं। क्लोरीन का इलेक्ट्रॉनिक विन्यास 2,8,7 होता है और यह इलेक्ट्रॉन विविध कोशों (K,L,M) में 2,8,7 के क्रम में वर्गीकृत रहते हैं। जब क्लोरीन परमाणु एक इलेक्ट्रॉन प्राप्त कर लेता है तब क्लोराइड आयन Cl- का निर्माण होता है। Cl- एक ऋणायन है जिस पर ऋण आवेश की एक इकाई होती है।
हाइड्राइड आयन की निर्माण (Formation of Hydride Ion)
हाइड्रोजन एक अधातु है। हाइड्रोजन के एक परमाणु में केवल 1 इलेक्ट्रॉन उसके K कोश में रहता है। जब हाइड्रोजन परमाणु एक और इलेक्ट्रॉन प्राप्त कर लेता है तब हाइड्रोजन आयन (H-) का निर्माण होता है। हाइड्रोजन आयन (H-) एक ऋणायन है जिसमें ऋण आवेश की एक इकाई होती है।
हाइड्रोजन एक अधातु है। हाइड्रोजन के एक परमाणु में केवल 1 इलेक्ट्रॉन उसके K कोश में रहता है। जब हाइड्रोजन परमाणु एक और इलेक्ट्रॉन प्राप्त कर लेता है तब हाइड्रोजन आयन (H-) का निर्माण होता है। हाइड्रोजन आयन (H-) एक ऋणायन है जिसमें ऋण आवेश की एक इकाई होती है।
ऑक्साइड आयन की निर्माण (Formation of Oxide Ion)
ऑक्सीजन भी एक अधातु है। ऑक्सीजन के एक परमाणु में 8 इलेक्ट्रॉन होते हैं जिनका इलेक्ट्रॉनिक विन्यास 2,6 होता है। यह इलेक्ट्रॉन विविध कोशों (K,L) में 2,6 के क्रम में वर्गीकृत रहते हैं। जब ऑक्सीजन का परमाणु 2 इलेक्ट्रॉन प्राप्त कर लेता है तब ऑक्साइड आयन का निर्माण होता है। ऑक्साइड आयन (O²-) एक ऋणायन है जिसमें ऋण आवेश की दो इकाइयां होती हैं।
ऑक्सीजन भी एक अधातु है। ऑक्सीजन के एक परमाणु में 8 इलेक्ट्रॉन होते हैं जिनका इलेक्ट्रॉनिक विन्यास 2,6 होता है। यह इलेक्ट्रॉन विविध कोशों (K,L) में 2,6 के क्रम में वर्गीकृत रहते हैं। जब ऑक्सीजन का परमाणु 2 इलेक्ट्रॉन प्राप्त कर लेता है तब ऑक्साइड आयन का निर्माण होता है। ऑक्साइड आयन (O²-) एक ऋणायन है जिसमें ऋण आवेश की दो इकाइयां होती हैं।
आयन की निर्माण द्वारा हमें यह पता चलता है कि तत्वों के परमाणु में धनायन तथा ऋणायन किस प्रकार से आता है इन दोनों विधियों को हम धनायन की निर्माण तथा ऋणायन की निर्माण द्वारा पूर्ण तरीके से जान सकते हैं।
इन्हें भी पढ़ें -






No comments:
Post a Comment